吸光光度法の操作には、試料の前処理、呈色反応、測定の三段階があります。このうち呈色反応について最初に考えてみましょう。
吸光光度法は、溶液内で起こる化学反応の微妙なバランスの上に成り立つ呈色反応を利用する点で、機器分析法の中でも最も化学らしい分析法といえます。
一つの目的成分に対して、数多くの呈色試薬が見出されており、これを活用する多様な研究・開発が行われています。例えば、鉄イオンは、テトラシアノ鉄イオンとの反応で青色に、アルカリ性でスルホサリチル酸と反応させると黄色に、還元剤を共存させて1,10−フェナントロリンとの反応では赤橙色に、チオシアン酸イオンとの反応では濃赤色を呈します。この他にも、数多くの呈色反応が鉄の定量に用いられています。その中でも、とくに、二価の鉄イオンと1,10−フェナントロリンとの錯体との呈色は、安定性、選択性、そして、感度などの点で優れています。
呈色試薬を選ぶ場合には、できるだけ共存成分による妨害が少なく、選択性に優れ、しかも、呈色が安定で高感度な試薬を選ぶことが必要です。そして、次のことも考えながら分析を行います。
- どのような目的で分析を行うのか?
- どのような情報を得ようとしているのか?
- どの程度の精度を求めているのか?
- 共存する成分の種類と量はどの位あるのか?どの位の時間と費用が許されるのか?
呈色操作を行う上での留意すべき点は、検討した定量条件に従って正しく操作すること、共存している成分による妨害について考慮することなどです。三価の鉄とスルホサリチル酸との反応を例にして説明しましょう。三価の鉄はスルホサリチル酸とは
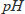
1〜2で、赤紫色を示します。しかし、鉄イオンの量が同じであっても、加えるスルホサリチル酸の量が少ないと、発色が不完全になります。そのため呈色反応には充分量の試薬の添加が必要です。
呈色反応は、溶液の酸濃度、
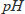
によって大きく影響を受けます。このようにスルホサリチル酸を完全に発色させた溶液に、アルカリを加え、
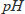
濃度を変化させると、
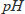
の高い方ほどより黄色に変わってくるのがわかります。
このように完全に発色するのに時間のかかる反応もあります。
再現性のある測定を得るためには、特に溶液の
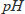
濃度、緩衝溶液の種類と量、試薬の濃度とその添加順序、反応時の温度と反応時間、などの定量条件を充分検討しておくことが必要です。
次に、共存成分への対策について考えて見ましょう。呈色を妨害する共存成分があるときに、この妨害を除く最も効果的な方法はマスキングです。例えば、二価のコバルトイオンは、アセトン溶液中でチオシアン酸イオンと反応して青色を示します。一方、三価の鉄イオンも、同じ操作でこのようにチオシアン酸イオンと濃赤色の錯体を生成します。
二価のコバルトイオンを定量するとき、三価の鉄イオンが共存すると、このように両方の色が混合した暗青色を示して、コバルトの定量が困難になります。このような時に、フッ化アンモニウムを添加すると、三価の鉄イオンが無色のテトラフロロ鉄イオンとなり、鉄とチオシアン酸イオンとの反応が妨げられ、コバルトだけを呈色、定量することができます。
こうした共存成分への対応としては、
- 妨害とならない波長の選択、
- 溶液の
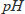 の変更、
の変更、
- 酸化還元反応によるイオン係数の変更、
- マスキング剤の添加、
- 沈殿、溶媒抽出、イオンクロマトグラフィー
による分離などの手段が挙げられます。
以上、吸光光度法は機器分析法の中でも最も基本的な原理の分析法ですが、この原理を拡張することによって、
- 二波長分光法
- 多波長同時測定法
- 高次微分分光光度法
- イオン交換体比色法
- ラピットスキャン分光光度法
- ストップドフロー分光光度法
- サーマルレンズ吸光光度法
- 光音響分析法
といった新しい分析法に応用されています。