光の吸収
光は光子(photon)と呼ばれるエネルギー粒子の流れであり、その各々は特定のエネルギー
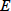
をもち、光の振動数
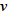
とは
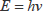
(
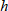
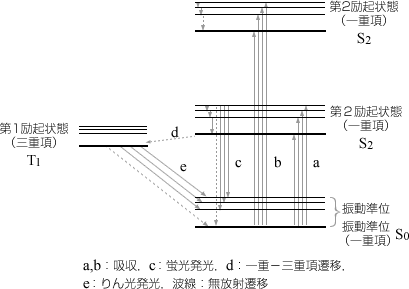
:プランクの定数)の関係があります。いいかえれば、ある振動数(または波長)の光は、一定のエネルギーをもった光子の流れです。光が物質に当たると、吸収、散乱、反射などの相互作用を生じますが、いま吸収について考えると、吸収は入射光がそのエネルギーを原子、分子、イオンなどの化学種に与えて、それらのもつエネルギー量を増加させることになります。この場合、化学種のエネルギーは不連続すなわち量子化(quantization)されていて、ある許容された状態しかとり得ないので、光を吸収してより高いエネルギー状態に遷移(transition)するためには、Bohrの条件、
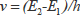
(2・1)
を満たすような波長の光だけを吸収します。(図2・2)
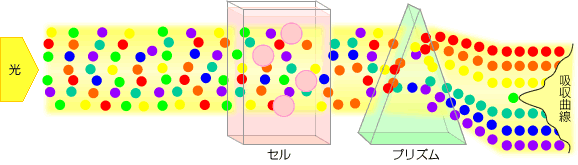
図2・2 吸光光度分析の原理
ここで、
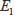
,
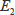
は光を吸収する前後の化学種のもつエネルギーです。
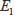
,
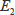
のとり得る値は様々ですが、それぞれの化学種について一定の外的条件では一定ですから、ある物質に白色光が入射したときに現れる吸収曲線、すなわち吸収スペクトルは物質ごとに一定であり、この事実が吸収スペクトルを定性分析に利用できる基礎になっています。
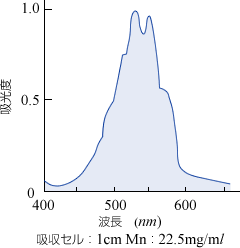
つまり溶液に光の粒子の混合である白色光を照射すると、溶けている科学種によって特有の光の粒子だけが吸収され、その残りの粒子が溶液を通過します。これをプリズムまたは回折格子で分けてみるとスペクトルに一部欠けた所が見られます。これから吸収曲線を画くことができます。吸収されずに透過してきた光の粒子を混合したものが溶液の色として見ているものと同じです。(図2・3)
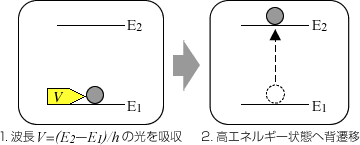
図2・3 基底状態・励起状態